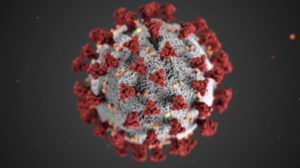
Da qualche mese questa immagine del Covid-19 è diventata parte del nostro immaginario collettivo e subconscio. Essa rappresenta la superficie esterna del virus, nota come corona, e racchiude l’agglomerato virionico interno come osservato al microscopio elettronico. Questa illustrazione, creata nel Centro Americano per il Controllo delle Malattie e Prevenzione (CDC), può essere scaricata liberamente (con codice #23313) senza restrizioni per i diritti d’autore e, proprio a quest’ultima, il Washington Post ha dedicato di recente un articolo.
Le evidenti protuberanze in colore rosso rappresentano la glicoproteina di punta, o spicola (spike), che emerge dall’involucro del virus che contiene il materiale genetico del patogeno. Questa proteina media l’aggancio e l’ingresso del virus nelle nostre cellule. Pertanto, la forma di tale proteina serve alla messa a punto di farmaci antivirali, analogamente ad altri virus influenzali di stagione. In poco tempo, in diversi laboratori, è stato possibile ricavare i dettagli atomici sperimentali non solo della spicola, ma anche di altre proteine che costituiscono il Covid-19, o proteine delle nostre cellule come l’enzima furina, le quali hanno un ruolo nella rapida riproduzione del virus. Queste immagini strutturali possiedono un grande valore biochimico, oltre a quello potenzialmente terapeutico. Tali strutture tridimensionali sono a disposizione del pubblico e possono essere esplorate in 3D accedendo all’archivio del Protein Data Bank (RCSB PDB).
Ciò che consente la ripida determinazione dei dettagli atomici dell’intero involucro virale, o di singole proteine che lo costituiscono, è frutto di una tecnica che si sta sviluppando velocemente: la crio-microscopia elettronica.
Fotografare oggetti invisibili all’occhio umano è essenziale alla comprensione delle funzioni cellulari o di altri materiali aventi diversa natura chimica. La tecnica di microscopia elettronica a temperature criogeniche, o semplicemente crio-microscopia elettronica, consente di generare immagini e modelli tridimensionali del campione in esame rivelando processi su scala atomica che resterebbero altrimenti sconosciuti. La crio-microscopia elettronica, prevedendo il rapido congelamento del campione come sottile strato di vetro, ovvia alla difficoltà di ottenere lo stesso allo stato cristallino. Quest’ultimo rappresenta il principale vantaggio per cui la crio-microscopia elettronica è emersa negli ultimi anni rispetto alle altre tecniche convenzionali del settore, tra cui la diffrazione ai raggi X. Attraverso l’uso del microscopio elettronico è possibile una rapida cattura delle immagini bidimensionali del campione contenuto nel vetro. Tali immagini consentono, mediante tecniche computazionali, l’ottenimento della struttura tridimensionale del campione d’interesse.
I campioni analizzabili possono essere di diversa natura: proteine, complessi macromolecolari, minerali, e molti altri. Nel 2016, ad esempio, questa tecnica consentì la determinazione della struttura tridimensionale del virus Zika, un’altra importante malattia virale trasmessa dalla puntura di alcune specie di zanzare infette. Attraverso la crio-microscopia elettronica è anche possibile ricavare l’immagine di complete sezioni cellulari all’interno del contesto cellulare, note come tomogrammi, permettendo di rivelare, senza l’impiego di marcatori chimici, funzioni cellulari finora sconosciute.
Rappresentazione della struttura tridimensionale dell’apparato della superficie esterna del COVID-19
La crescita e l’utilizzo della crio-microscopia elettronica in molti laboratori di ricerca nel mondo è il risultato delle tappe rivoluzionarie raggiunte dagli scienziati Jaques Dubochet (Università di Losanna), Joachim Frank (Columbia University) e Richard Henderson (MRC Laboratory of Molecular Biology), ai quali è stato conferito nel 2017 il Premio Nobel per la chimica. Ciascuno di questi scienziati ha sviluppato un diverso aspetto della tecnica, consentendone una crescita di utilizzo.
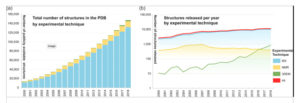
I grafici di seguito indicano il numero di strutture tridimensionali di proteine e acidi nucleici determinate nei laboratori di biologia strutturale del pianeta – le quali sono distribuite gratuitamente dall’archivio mondiale di proteine (PDB). Degno di nota è l’aumento del numero di strutture molecolari determinate grazie alla crio-microscopia elettronica (3DEM, curva in verde), superiore anche a quelle ottenute mediante risonanza magnetica nucleare (NMR).
Crescita del numero di strutture determinate da crio microscopia elettronica 3DEM (Protein Science, 2019).
Come accennato, al cuore di questa tecnica c’è l’uso del crio-microscopio elettronico che consente di catturare immagini dirette del campione in alta risoluzione. Il crio-microscopio elettronico racchiude componenti principali che ricordano il comune microscopio ottico anche se, a differenza di quest’ultimo, non utilizza come sorgente la luce bianca, ma piuttosto un fascio di elettroni accelerati nel vuoto del cammino ottico dello strumento. Rispetto al microscopio ottico, il microscopio elettronico ha un potere risolutivo del campione su scala atomica. Anche se il primo crio-microscopio elettronico fu assemblato già a partire dagli anni Venti dal Dr. E. Ruska (Premio Nobel 1986), solamente la messa appunto, nel 2013, di camere digitali per la lettura diretta degli elettroni provenienti dal campione illuminato e posizionate nella sezione post colonna, ha reso possibile quella rivoluzione nota come “rivoluzione nella risoluzione” (dall’inglese resolution revolution).
Nel corrente mercato globale vi è un numero limitato di microscopi elettronici che si differenziano principalmente rispetto al potere risolutivo e al tipo di camera digitale. L’azienda Fisher Thermo Scientific, avente sede anche in Italia, produce attualmente microscopi elettronici. Ad oggi, l’unico crio-microscopio elettronico ad alta risoluzione operante in Italia si trova presso l’università di Milano, nei laboratori diretti dal Prof. M. Bolognesi e dal Dottor P. Swuec. Tale microscopio ha già permesso la pubblicazione di articoli ad alto impatto scientifico.
Il crio-microscopio elettronico ben si adatta a diversi settori scientifico disciplinari. La sua compattezza e la sua stabilità contribuiscono a rendere rilevanti i costi e la manutenzione nel tempo. Tuttavia nonostante questi svantaggi, la facilità di utilizzo, da parte di ricercatori provenienti da diversi settori disciplinari, presuppone una formazione alquanto breve. Anche presso l’università di Pavia un nuovo laboratorio di crio-miscroscopia elettronica diretto verrà inaugurato prossimamente.
Oltre agli ovvi interessi per la salute pubblica e quelli scientifici di cui beneficia una struttura accademica avente in dotazione un crio-microscopio elettronico, ulteriori guadagni riguardano aspetti quali l’internazionalizzazione delle università mediante l’attrazione di studenti stranieri e i loro premi di ricerca; l’aumento del numero di ricercatori i cui progetti richiedono l’uso di tale del crio-microscopio elettronico; la possibilità di attrarre l’interesse scientifico di importanti case farmaceutiche pronte a finanziare l’accademia.
In prima persona ho potuto constatare l’assenza di un crio-microscopio elettronico ad alta risoluzione nelle università del territorio del Sud Italia.
Recentemente, sulla nota rivista Science, è stato pubblicato un articolo dal titolo We need a people’s cryo-EM. Scientists hope to bring revolutionary microscope to the masses (E. Hand, Science Jan 23, 2020) in cui si sottolineava l’importanza della crio-microscopia elettronica, la sua rapida crescita e la necessità di crio-microscopi elettronici da parte dei ricercatori.